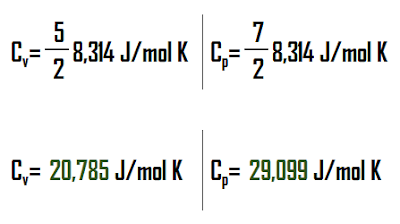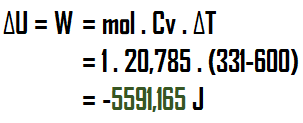Soal 1 : Neraca Massa 1 unit tanpa reksi
Air laut yang mengandung 3,5%-berat garam mengalir melalui 10 evaporator yang disusun seri. Jumlah air yang teruapkan ditiap 10 unit evaporator adalah sama yang kemudian seluruh air ini dikondensasi dan digabung alirannya hingga didapatkan 1 aliran produk "fresh water". Produk Air garam yang keluar dari evaporator ke-10 mengandung 5%-berat garam.
Tentukanlah:
(a) Yield "fresh water" dari proses ini (kg H2O yang terambil/kg H2O dari umpan)
(b) Persen berat garam dari air garam yang keluar dari evaporator ke-4
Tentukanlah:
(a) Yield "fresh water" dari proses ini (kg H2O yang terambil/kg H2O dari umpan)
(b) Persen berat garam dari air garam yang keluar dari evaporator ke-4
JAWABAN
(a) Diagram berikut menggambarkan proses evaporasi 10 tahap dengan evaporator ke-1, ke-4 dan ke-10 yang menjadi perhatian
Untuk menghitung yield fresh water, kita membutuhkan data massa H2O yang berada diumpan dan H2O yang terambil. Diagram dibawah ini menampilkan neraca massa overall dari kasus evaporator 10 tahap ini. Aliran air yang disimbolkan [FA] merupakan total air yang diperoleh ditiap tahap evaporasi.
Sehingga Yield H2O bisa dihitung sebagai berikut:
(b) Jumlah air yang keluar dari evaporator adalah sama untuk setiap 10 evaporator tersebut. Jumlah air total yang berhasil diambil keluar dari sistem 10 evaporator adalah sama dengan nilai FA=30 kg. Sehingga, dari 1 evaporator, air yang keluar adalah sebesar =30/10 =3 kg
Umpan dari evaporator ke-4 merupakan keluaran dari evaporator ke 3 yang sudah mengalami 3 kali proses evaporasi sehingga jumlah garamnya sekarang adalah = 100 - (3 x 3 kg) = 91 kg
Keluaran dari evaporator ke-4 adalah [F5] = 91 kg - 3 kg = 88 kg.
Berikutnya, jumlah garam yang berada di keluaran evaporator ke-4 adalah sama dengan jumlah garam yang berada di line umpan awal (F1) yaitu sebesar 3,5% x 100 kg= 3,5 kg
Sehingga, %berat garam dalam aliran keluaran evaporator ke-4 adalah
Untuk menghitung yield fresh water, kita membutuhkan data massa H2O yang berada diumpan dan H2O yang terambil. Diagram dibawah ini menampilkan neraca massa overall dari kasus evaporator 10 tahap ini. Aliran air yang disimbolkan [FA] merupakan total air yang diperoleh ditiap tahap evaporasi.
Jumlah garam di umpan air laut [F1] adalah sama dengan jumlah garam di akhir tahap evaporasi [F11]
Dari neraca massa overall, didapat bahwa
Sehingga Yield H2O bisa dihitung sebagai berikut:
(b) Jumlah air yang keluar dari evaporator adalah sama untuk setiap 10 evaporator tersebut. Jumlah air total yang berhasil diambil keluar dari sistem 10 evaporator adalah sama dengan nilai FA=30 kg. Sehingga, dari 1 evaporator, air yang keluar adalah sebesar =30/10 =3 kg
Umpan dari evaporator ke-4 merupakan keluaran dari evaporator ke 3 yang sudah mengalami 3 kali proses evaporasi sehingga jumlah garamnya sekarang adalah = 100 - (3 x 3 kg) = 91 kg
Keluaran dari evaporator ke-4 adalah [F5] = 91 kg - 3 kg = 88 kg.
Berikutnya, jumlah garam yang berada di keluaran evaporator ke-4 adalah sama dengan jumlah garam yang berada di line umpan awal (F1) yaitu sebesar 3,5% x 100 kg= 3,5 kg
Sehingga, %berat garam dalam aliran keluaran evaporator ke-4 adalah
Soal 2 : Neraca Massa 1 unit tanpa reksi
Sebuah Produk Jus Jeruk Pekat (JJP) mengandung 42% berat padatan dibuat dari Jus Jeruk Segar (JJS) yang mengandung 12%-berat padatan dan sisanya air. Awalanya, untuk mengurangi kandungan air, digunakan proses evaporasi, namun ternyata ada sebagian kandungan jus yang ikut teruapkan bersama air yang menyebabkan rasa jus menjadi berubah. Untuk mengatasi masalah ini, dibuat jalur bypass untuk sebagian Jus Jeruk Segar tanpa harus melewati proses evaporasi. Jus yang keluar dari evaporator mengandung 58%-berat padatan dan aliran keluar evaporator ini dicampur dengan sebagian Jus Jeruk Segar yang dibypass dari umpan awal tadi untuk mendapatkan konsentrasi yang diinginkan pada Produk Jus Jeruk Pekat.
Asumsi :
1. Didalam sistem ini hanya ada 2 komponen yaitu padatan dan air.
2. Tidak ada padatan yang terbawa bersama air yang teruapkan dari evaporator
Tentukanlah:
(a) Jumlah Produk Jus Jeruk Pekat yang diproduksi per 100 kg Jus Jeruk Segar
(b) Fraksi Umpan yang di-bypass
Asumsi :
1. Didalam sistem ini hanya ada 2 komponen yaitu padatan dan air.
2. Tidak ada padatan yang terbawa bersama air yang teruapkan dari evaporator
Tentukanlah:
(a) Jumlah Produk Jus Jeruk Pekat yang diproduksi per 100 kg Jus Jeruk Segar
(b) Fraksi Umpan yang di-bypass
JAWABAN
Sehingga didapatlah Jumlah Produk Jus Jeruk Pekat yang diproduksi sebesar F5=28,57 kg dan air sebanyak F3=71,43 kg
(b) Untuk menghitung fraksi umpan yang dibypass, kita memerlukan data flow aliran F6 yang dapat dihitung menggunakan neraca massa pada alat mixing yang melibatkan aliran 4,5,6.
Kita tinjau terlebih dahulu neraca massa mixing sebagai berikut:
Berikutnya, untuk neraca massa padatan pada alat mixing adalah sebagai berikut :
Dengan menyelesaikan kedua persamaan diatas, didapat F4=18,63 kg dan F6=9,94 kg
Sehingga rasio bypass dapat dihitung sebagai berikut:
Referensi:
[1] Elementary Principles of Chemical Processes, Felder and Rousseau