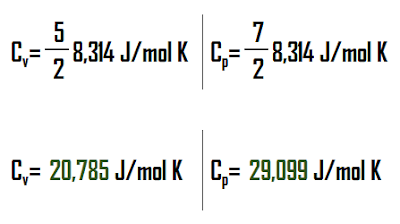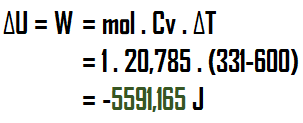Soal 1 : Siklus Termodinamika
1 mol sebuah gas ideal dengan Cp=(7/2)R dan Cv=(5/2)R mengalami ekspansi dari P1 = 8 bar dan T1 = 600 K menuju P2 = 1 bar dengan melalui tahapan berikut:
(a) Volume konstan atau Isovolume
(b) Temperatur konstan atau Isoterm
(c) Adiabatis
Hitunglah Energi dalam (U), Kalor (Q), dan Kerja (W) untuk tiap proses, gambarkan tiap tahap tersebut dalam 1 diagram PV.
JAWABAN
Nilai Cp dan Cv berikut dapat digunakan untuk perhitungan:
(a) Pada kondisi volume konstan, nilai kerja (W) adalah = 0 (nol). Sehingga nilai kalor akan sama dengan nilai energi dalam yaitu :
Untuk menghitung energi dalam dan kalor tersebut dibutuhkan nilai temperatur pada kondisi akhir (T2)
Sehingga, nilai energi dalam (U) dan nilai kalornya (Q) dapat dihitung sebagai berikut:
Sehingga, untuk kasus isovolume, diperoleh nilai W = 0, U=Q=-10912,125 Joule
(b) Pada kondisi temperatur konstan, nilai energi dalam (U) adalah = 0 (nol). Sehingga nilai kalor akan sama dengan nilai kerja namun hanya berbeda tanda.
Sehingga, untuk kasus isoterm, diperoleh nilai U=0, Q=10373,086 J, dan W= -10373,086 J
(c) Pada kondisi adiabatik, nilai kalor (Q) adalah = 0 (nol). Sehingga nilai energi dalam akan sama dengan nilai kerja.
Sehingga, untuk kasus adiabatik, diperoleh nilai Q=0, U=W=-5591,165 J
Apabila ketiga kasus tersebut digambarkan dalam diagram PV, akan diperoleh ilustrasi sebagai berikut:
Soal 2 : Siklus Termodinamika
(a) Siklus tersebut dapat digambarkan pada diagram PV sebagai berikut:
(b) Dari deskripsi soal, diketahui bahwa P1 = 10 bar, T1 = 600 K, P2 = 3 bar, dan P3 = 2 bar. Artinya, kita tinggal mencari T2, T3, P4, dan T4
1-2 merupakan garis isoterm yang artinya antara titik 1 dan 2 memiliki temperatur yang sama, T2=T1= 600 K.
3-4 merupakan garis isobar yang artinya antara titik 3 dan 4 memiliki tekanan yang sama, P4=P3= 2 bar
2-3 merupakan garis isovolume. Sehingga untuk menghitung Temperatur pada titik 3 dapat dilakukan sebagai berikut:
1-4 merupakan garis adiabatik. Sehingga untuk menghitung Temperatur pada titik 4 dapat dilakukan sebagai berikut:
Referensi:
[1] Introduction to Chemical Engineering Thermodynamics 7th Edition, J.M Smith, H.C. Van Ness, M.M. Abbott
[2] Fundamental of Physics 8th Edition Extended, Halliday and Resnick
(a) Volume konstan atau Isovolume
(b) Temperatur konstan atau Isoterm
(c) Adiabatis
Hitunglah Energi dalam (U), Kalor (Q), dan Kerja (W) untuk tiap proses, gambarkan tiap tahap tersebut dalam 1 diagram PV.
JAWABAN
Nilai Cp dan Cv berikut dapat digunakan untuk perhitungan:
(a) Pada kondisi volume konstan, nilai kerja (W) adalah = 0 (nol). Sehingga nilai kalor akan sama dengan nilai energi dalam yaitu :
Untuk menghitung energi dalam dan kalor tersebut dibutuhkan nilai temperatur pada kondisi akhir (T2)
Sehingga, nilai energi dalam (U) dan nilai kalornya (Q) dapat dihitung sebagai berikut:
Sehingga, untuk kasus isovolume, diperoleh nilai W = 0, U=Q=-10912,125 Joule
(b) Pada kondisi temperatur konstan, nilai energi dalam (U) adalah = 0 (nol). Sehingga nilai kalor akan sama dengan nilai kerja namun hanya berbeda tanda.
Sehingga, untuk kasus isoterm, diperoleh nilai U=0, Q=10373,086 J, dan W= -10373,086 J
(c) Pada kondisi adiabatik, nilai kalor (Q) adalah = 0 (nol). Sehingga nilai energi dalam akan sama dengan nilai kerja.
Untuk menghitung energi dalam dan kerja tersebut dibutuhkan nilai temperatur pada kondisi akhir (T2). Namun tentu saja nilai T2 ini berbeda dengan kasus (a) karena pada kasus (c) kondisinya adalah adiabatik sehingga yang digunakan untuk menghitung T2 adalah sebagai berikut:
Setelah didapat nilai T2, maka dapat dihitung nilai energi dalam dan kerjanya sebagai berikut:Sehingga, untuk kasus adiabatik, diperoleh nilai Q=0, U=W=-5591,165 J
Apabila ketiga kasus tersebut digambarkan dalam diagram PV, akan diperoleh ilustrasi sebagai berikut:
Soal 2 : Siklus Termodinamika
Sebuah gas ideal memiliki temperatur dan tekanan mula-mula sebesar 600 K dan 10 bar mengalami 4 tahap siklus dalam sistem tertutup. Pada tahap 1-2, tekanan diturunkan secara isotermal hingga bertekanan 3 bar; pada tahap 2-3 tekanan diturunkan kembali secara isovolume hingga 2 bar; pada tahap 3-4, volumenya diturunkan pada tekanan tetap. dan pada tahap 4-1, gas tersebut kembali ke keadaan awalnya secara adiabatis. Bila Cp=(7/2)R dan Cv=(5/2)R,
(a) Gambarkan siklus tersebut pada diagram PV
(b) Tentukan P dan T pada keadaan 1,2,3,4
JAWABAN(a) Gambarkan siklus tersebut pada diagram PV
(b) Tentukan P dan T pada keadaan 1,2,3,4
(a) Siklus tersebut dapat digambarkan pada diagram PV sebagai berikut:
(b) Dari deskripsi soal, diketahui bahwa P1 = 10 bar, T1 = 600 K, P2 = 3 bar, dan P3 = 2 bar. Artinya, kita tinggal mencari T2, T3, P4, dan T4
1-2 merupakan garis isoterm yang artinya antara titik 1 dan 2 memiliki temperatur yang sama, T2=T1= 600 K.
3-4 merupakan garis isobar yang artinya antara titik 3 dan 4 memiliki tekanan yang sama, P4=P3= 2 bar
2-3 merupakan garis isovolume. Sehingga untuk menghitung Temperatur pada titik 3 dapat dilakukan sebagai berikut:
1-4 merupakan garis adiabatik. Sehingga untuk menghitung Temperatur pada titik 4 dapat dilakukan sebagai berikut:
Referensi:
[1] Introduction to Chemical Engineering Thermodynamics 7th Edition, J.M Smith, H.C. Van Ness, M.M. Abbott
[2] Fundamental of Physics 8th Edition Extended, Halliday and Resnick