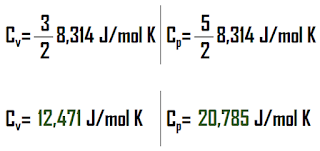Soal 1 : Konsep Dasar Termodinamika
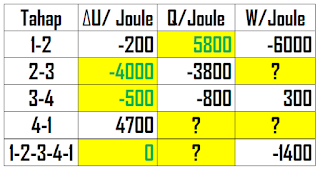
1 mol gas yang berada dalam sistem tertutup melalui 4 tahapan siklus termodinamika. Dengan menggunakan data energi dalam, kalor, dan kerja yang diberikan pada tabel berikut, tentukan seluruh parameter yang belum diketahui pada tabel tersebut! (ditandai dengan tanda "?")
JAWABAN
Untuk menyelesaikan masalah ini, kita gunakan hukum 1 termodinamika :
Perhitungan dimulai dari tahapan yang sudah memiliki 2 variabel diketahui, yaitu 1-2. Dengan menggunakan rumus diatas, didapat nilai Q untuk tahap 1-2 adalah 5800
Berikutnya, dapat dihitung nilai U pada tahap 3-4, didapat nilai U pada tahap 3-4 adalah -500 J.
Berikut tabel update setelah kita melakukan perhitungan pada tahap 1-2 dan 3-4
Nilai energi dalam (U) siklus, 1-2-3-4-1, adalah 0 sesuai dengan hukum termodinamika yang menyatakan bahwa
"Dalam sebuah proses siklus dimana sistem kembali ke keadaan awalnya, nilai energi dalamnya tidak berubah"
Sehingga, nilai energi dalam (U) tahap 2-3 bisa dihitung
Berikut tabel update setelah kita melakukan perhitungan pada kolom energi dalam (U)
Selanjutnya, nilai W untuk tahap 2-3 serta nilai Q total (1-2-3-4-1) dapat dihitung sehingga tabel diatas menjadi
Akhirnya, Nilai Q dan nilai W tahap 4-1 dapat dihitung dengan meninjau Q dan W total
Untuk menyelesaikan masalah ini, kita gunakan hukum 1 termodinamika :
Perhitungan dimulai dari tahapan yang sudah memiliki 2 variabel diketahui, yaitu 1-2. Dengan menggunakan rumus diatas, didapat nilai Q untuk tahap 1-2 adalah 5800
Berikutnya, dapat dihitung nilai U pada tahap 3-4, didapat nilai U pada tahap 3-4 adalah -500 J.
Berikut tabel update setelah kita melakukan perhitungan pada tahap 1-2 dan 3-4
Nilai energi dalam (U) siklus, 1-2-3-4-1, adalah 0 sesuai dengan hukum termodinamika yang menyatakan bahwa
"Dalam sebuah proses siklus dimana sistem kembali ke keadaan awalnya, nilai energi dalamnya tidak berubah"
Sehingga, nilai energi dalam (U) tahap 2-3 bisa dihitung
Berikut tabel update setelah kita melakukan perhitungan pada kolom energi dalam (U)
Selanjutnya, nilai W untuk tahap 2-3 serta nilai Q total (1-2-3-4-1) dapat dihitung sehingga tabel diatas menjadi
Akhirnya, Nilai Q dan nilai W tahap 4-1 dapat dihitung dengan meninjau Q dan W total
Soal 2 : Siklus Termodinamika
Sebuah sampel gas ideal melalui siklus seperti pada gambar dibawah ini dengan Tekanan pada titik b = 7,5 kPa dan Tekanan pada titik a dan c = 2,5 kPa. Pada titik a, T=200K. Tentukan:
(a) mol gas pada sampel tersebut
(b) Temperatur pada titik b dan c
(c) Energi/Kerja total yang terlibat selama gas mengalami siklus tersebut
(a) mol gas pada sampel tersebut
(b) Temperatur pada titik b dan c
(c) Energi/Kerja total yang terlibat selama gas mengalami siklus tersebut
JAWABAN
(a) mol gas dapat dihitung menggunakan data pada titik a karna pada titik a sudah diketahui nilai P, V, dan T nya dari grafik maupun dari keterangan soal. Asumsi mol gas pada tiap titik di siklus tersebut sama
Titik a
P = 2,5 kPa, V = 1 m3, T= 200 K
(b) Untuk menghitung Temperatur pada titik B, dapat digunakan perbandingan persamaan gas ideal antara titik A dan B dengan asumsi bahwa nilai mol dan R tetap seperti yang ditunjukkan pada persamaan berikut

Untuk menghitung Temperatur pada titik c, bisa menggunakan perbandingan antara titik a-c atau b-c karena baik titik a maupun b sudah memiliki nilai P, V, dan T yang diketahui dan terhitung pada persoalan sebelumnya. Saya menggunakan hubungan titik a dan c untuk menghitung Temperatur pada titik c.
a-c merupakan garis isobar yang artinya titik a dan c memiliki tekanan yang sama. Sehingga,
(c) Energi total dapat dihitung menggunakan luas didalam kurva siklus termodinamika. Karena bentu siklus tersebut adalah segitiga, maka dapat dihitung nilai energi total menggunakan rumus luas segitiga
(a) mol gas dapat dihitung menggunakan data pada titik a karna pada titik a sudah diketahui nilai P, V, dan T nya dari grafik maupun dari keterangan soal. Asumsi mol gas pada tiap titik di siklus tersebut sama
Titik a
P = 2,5 kPa, V = 1 m3, T= 200 K
(b) Untuk menghitung Temperatur pada titik B, dapat digunakan perbandingan persamaan gas ideal antara titik A dan B dengan asumsi bahwa nilai mol dan R tetap seperti yang ditunjukkan pada persamaan berikut

Untuk menghitung Temperatur pada titik c, bisa menggunakan perbandingan antara titik a-c atau b-c karena baik titik a maupun b sudah memiliki nilai P, V, dan T yang diketahui dan terhitung pada persoalan sebelumnya. Saya menggunakan hubungan titik a dan c untuk menghitung Temperatur pada titik c.
a-c merupakan garis isobar yang artinya titik a dan c memiliki tekanan yang sama. Sehingga,
(c) Energi total dapat dihitung menggunakan luas didalam kurva siklus termodinamika. Karena bentu siklus tersebut adalah segitiga, maka dapat dihitung nilai energi total menggunakan rumus luas segitiga
Soal 3 : Siklus Termodinamika
Gambar dibawah menunjukkan sebuah siklus termodinamika yang dilalui oleh 1 mol gas ideal monoatomic. Temperatur pada titik a,b,c secara berturut-turut adalah 300, 600, dan 455 K. Tentukanlah:
(a) Nilai Q, U, dan W pada tahap a-b
(b) Nilai Q, U, dan W pada tahap b-c
(c) Nilai Q, U, dan W pada tahap c-a
(d) Nilai Q, U, dan W pada total siklus a-b-c-a
Jika Tekanan pada titik a adalah 10^5 Pa, maka tentukanlah
(e) Volume dan Tekanan pada titik b
(a) Nilai Q, U, dan W pada tahap a-b
(b) Nilai Q, U, dan W pada tahap b-c
(c) Nilai Q, U, dan W pada tahap c-a
(d) Nilai Q, U, dan W pada total siklus a-b-c-a
Jika Tekanan pada titik a adalah 10^5 Pa, maka tentukanlah
(e) Volume dan Tekanan pada titik b
JAWABAN
Untuk sebuah gas ideal monoatomik, nilai Cv dan Cp nya adalah sebagai berikut:
(a) Tahap a-b merupakan tahap yang isovolume/isokhorik (volumenya tetap), sehingga memiliki nilai W = 0. Dengan kata lain, nilai energi dalamnya sama dengan nilai kalornya :
(b) Tahap b-c merupakan tahap adiabatik, sehingga memiliki nilai Q=0. Dengan kata lain,nilai energi dalamnya sama dengan nilai kerjanya
(e) Titik a dan b dihubungkan oleh garis isovolume, artinya, volume pada titik a dan b adalah sama. Volume a dapat dihitung menggunakan persamaan gas ideal
Referensi:
[1] Introduction to Chemical Engineering Thermodynamics 7th Edition, J.M Smith, H.C. Van Ness, M.M. Abbott
[2] Fundamental of Physics 8th Edition Extended, Halliday and Resnick
Untuk sebuah gas ideal monoatomik, nilai Cv dan Cp nya adalah sebagai berikut:
(b) Tahap b-c merupakan tahap adiabatik, sehingga memiliki nilai Q=0. Dengan kata lain,nilai energi dalamnya sama dengan nilai kerjanya
(c) Tahap c-a merupakan tahap isobarik (tekanan tetap)
(d) Nilai Q, W, dan Energi dalam siklus a-b-c-a dapat dihitung dengan menjumlahkan seluruh nilai yang telah dihitung pada bagian (a)-(c)(e) Titik a dan b dihubungkan oleh garis isovolume, artinya, volume pada titik a dan b adalah sama. Volume a dapat dihitung menggunakan persamaan gas ideal
Tekanan pada titik b dapat dihitung menggunakan perbandingan berikut (isovolume):
Referensi:
[1] Introduction to Chemical Engineering Thermodynamics 7th Edition, J.M Smith, H.C. Van Ness, M.M. Abbott
[2] Fundamental of Physics 8th Edition Extended, Halliday and Resnick